Delețiile recurente, care se traduc prin pierderea de funcție (loss-of-function), provoacă, în mod uzual, inactivarea genelor tumorale supresoare, dar implică adesea și deleția colaterală a unor gene aflate în proximitatea cromozomilor, generând dependența de paralogi (o pereche de gene care derivă din aceeași genă ancestrală, și care acum se află în locații diferite, în cadrul aceluiași genom) care mențin o funcție similară. Deși acești paralogi sunt ținte anticancerigene atractive, nu există nicio metodologie pentru a descoperi astfel de gene letale colaterale. În cadrul acestui studiu, a fost raportat un cadru pentru identificarea genelor letale colaterale cu ajutorul a ceea ce se numește „flux metabolism” (CLIM), folosit pentru a descoperi MTHFD2, și potențialul ei de a fi o genă letală colaterală în tumorile ovariene datorate delecțiilor UQCR11.
Echipa științifică au mai arătat că MTHFD2 are funcție oxidativă (NAD+ mitocondrial), alături de demonstrarea reglării activității metabolice sistemice prin calea metabolică paralogică care menține compensarea fluxurilor metabolice. Această letalitate colaterală UQCR11-MTHFD2 este confirmată in vivo, inhibarea MTHFD2 ducând la o remisiune completă a tumorilor, însă fără deleție UQCR11. Utilizând învățarea automată a CLIM și analiza fluxului metabolic, dar la scară genomică, ei au elucidat eficacitatea largă a direcționării MTHFD2, chiar și în ciuda profilurilor genetice distincte ale cancerului, care coexistă cu deleția UQCR11, și indiferent de compoziția stromală a tumorilor.
Descoperirea „unui punct slab” al cancerului
Cercetătorii de la Universitatea din Michigan și Universitatea din Indiana au reușit să descopere ceea ce ei au numit „un punct slab al cancerului”, respectiv faptul că modul în care aceste celule tumorale își asigură creșterea necontrolată poate fi, de asemenea, o slăbiciune care poate fi ușor explorată pentru a trata cancerul. Algoritmul de învățare automată pe care l-au dezvoltat poate identifica genele de rezervă pe care doar celulele tumorale le folosesc, ceea ce ar putea permite medicamentelor să vizeze, cu precizie și țintit, cancerul. Cercetătorii au folosit șoareci pentru a demonstra abordarea lor inovatoare din domeniul medicinei de precizie (precision medicine), pentru tratarea cancerului ovarian. În plus, comportamentul celular care dezvăluie toate aceste vulnerabilități este comun pentru majoritatea cancerelor, ceea ce implică faptul că algoritmii ar putea genera planuri de tratament viabile și pentru alte tipuri de cancere.
„Acest lucru ar putea revoluționa domeniul medicinei de precizie, datorită acțiunii țintite, bine targetate, a medicamentelor, care va afecta și ucide doar celulele canceroase, iar cele normale nu vor mai fi afectate”, a declarat Deepak Nagrath, profesor asociat de inginerie biomedicală, Universitatea din Michigan, și autor principal al studiului publicat în Nature Metabolism. El a mai declarat că: „Majoritatea medicamentelor împotriva cancerului afectează țesuturile, alături de celulele normale. Cu toate acestea, strategia noastră permite direcționarea specifică a tuturor medicamentelor spre celulele canceroase”.
Dezvoltarea unei metode numite „letalitate colaterală”
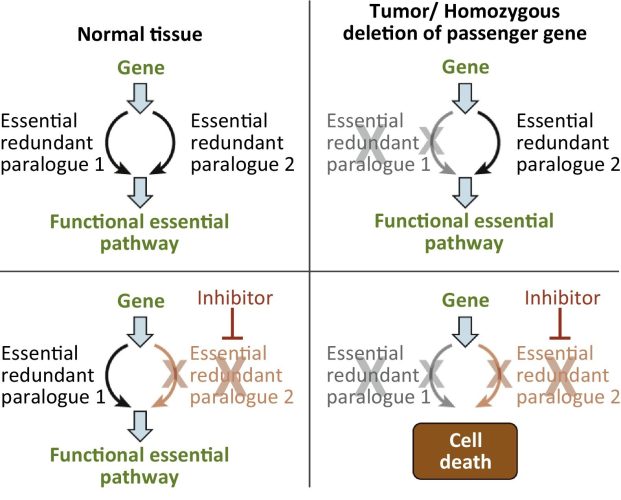
Această metodă este cunoscută sub numele de „letalitate colaterală” (collateral lethality) și, de altfel, presupune valorifica informațiilor dobândite de la genele pe care celulele canceroase le elimină pentru a identifica și găsi punctele slabe. Organismul uman este echipat cu mijloace viabile de apărare împotriva cancerului. Înainte, spre exemplu, celulele canceroase aveau gene supresoare care le împiedicau să se răspândească, controlând puncte cheie ale ciclului celular, moartea celulară programată (apoptoza), metabolismul și altele. Totuși, aceste celule dispun de diferite strategii inteligente pentru a face față acestor situații – pur și simplu, „șterg” o porțiune din ADN-ul lor: exact acea porțiune care conține genele supresoare antitumorale.
Făcând acest lucru, celulele pierde, de obicei, alte gene care sunt necesare, vitale pentru a putea supraviețui în continuare. Pentru a evita moartea, în schimb, celulele găsesc un paralog – adică o altă genă care ar putea îndeplini o funcție similară cu cea pe care ar fi îndeplinit-o gena pierdută. De obicei, există una sau, eventual, două gene care pot interveni și îndeplini aceeași funcție astfel încât celula să rămână în viață. Cercetătorii s-au întrebat ce s-ar întâmpla dacă paralogul potrivit ar putea fi identificat, iar apoi direcționat într-un mod care să oprească funcția vitală pentru ca o celulă să poată rămâne în viață?
„Atunci când nu este disponibil un înlocuitor direct pentru gena metabolică eliminată, putem folosi algoritmii noștri care fac uz de un model matematic al metabolismului celulelor tumorale și canceroase pentru a preciza calea metabolică paralogă pe care aceasta ar putea-o folosi”, este ce a declarat Abhinav Achreja, cercetător la Universitatea din Michigan în domeniu, unul dintre autorii principali ai lucrării de cercetare. „Aceste căi metabolice sunt importante, vitale, pentru celulele canceroase, și pot fi țintite selectiv”. Atacarea căilor metabolice inactivează în primul rând sursa energetică a celulei. Examinând celulele cancerului ovarian, echipa de cercetători s-a concentrat asupra unei gene, UQCR11, care a fost deseori eliminată împreună cu o altă genă supresoare. UQCR11 joacă un rol vital în respirația celulară – proces prin care celulele fac uz de glucoză pentru a obține energie, deci pentru a supraviețui.
Tulburările în acest proces pot produce un dezechilibru major al unui metabolit de importanță vitală, NAD+, în mitocondrii (organit în care are loc respirația celulară). Cu toate acestea, când vine vorba de supraviețuire, celulele canceroase continuă să prospere folosind alte metode prin care pot obține energie. Algoritmul dezvoltat de cei de la Universitatea din Michigan a reușit să sorteze corect mai multe opțiuni și a prezis cu succes că o celulă căreia îi lipsește UQCR11 se va îndrepta către gena MTHFD2, drept furnizor de NAD+. Rezultatele au fost validate prin experimente științifice, pe modele de celule modificate genetic și modele animale care sufereau de cancer ovarian datorat respectivelor deleții. Șase din șase șoareci testați au prezentat, după tratament, o remisiune completă a cancerului.